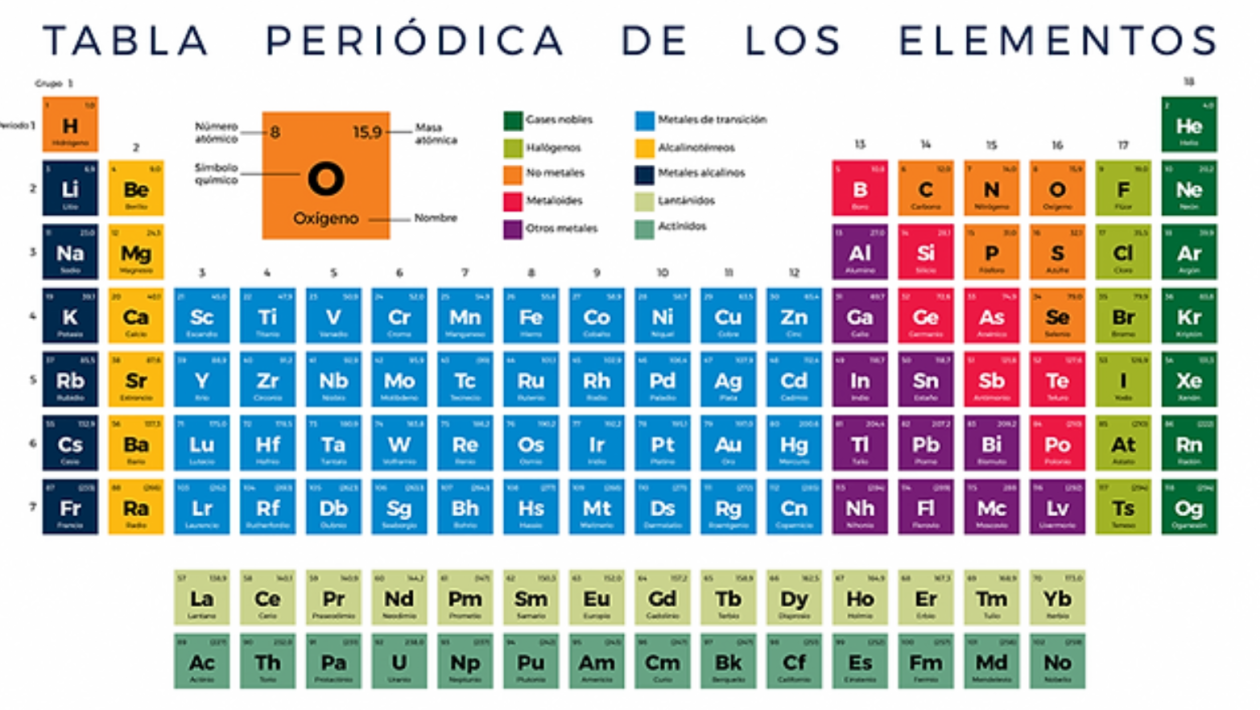
Tabla periódica de los elementos
La tabla periódica es una herramienta fundamental en el estudio de la química y comprende una organización sistemática de los elementos químicos. Proporciona información valiosa sobre las propiedades y características de cada elemento, incluyendo su símbolo, número atómico, masa atómica y configuración electrónica. Además, la tabla periódica está dividida en grupos y periodos, lo que permite clasificar y comparar los elementos de manera ordenada.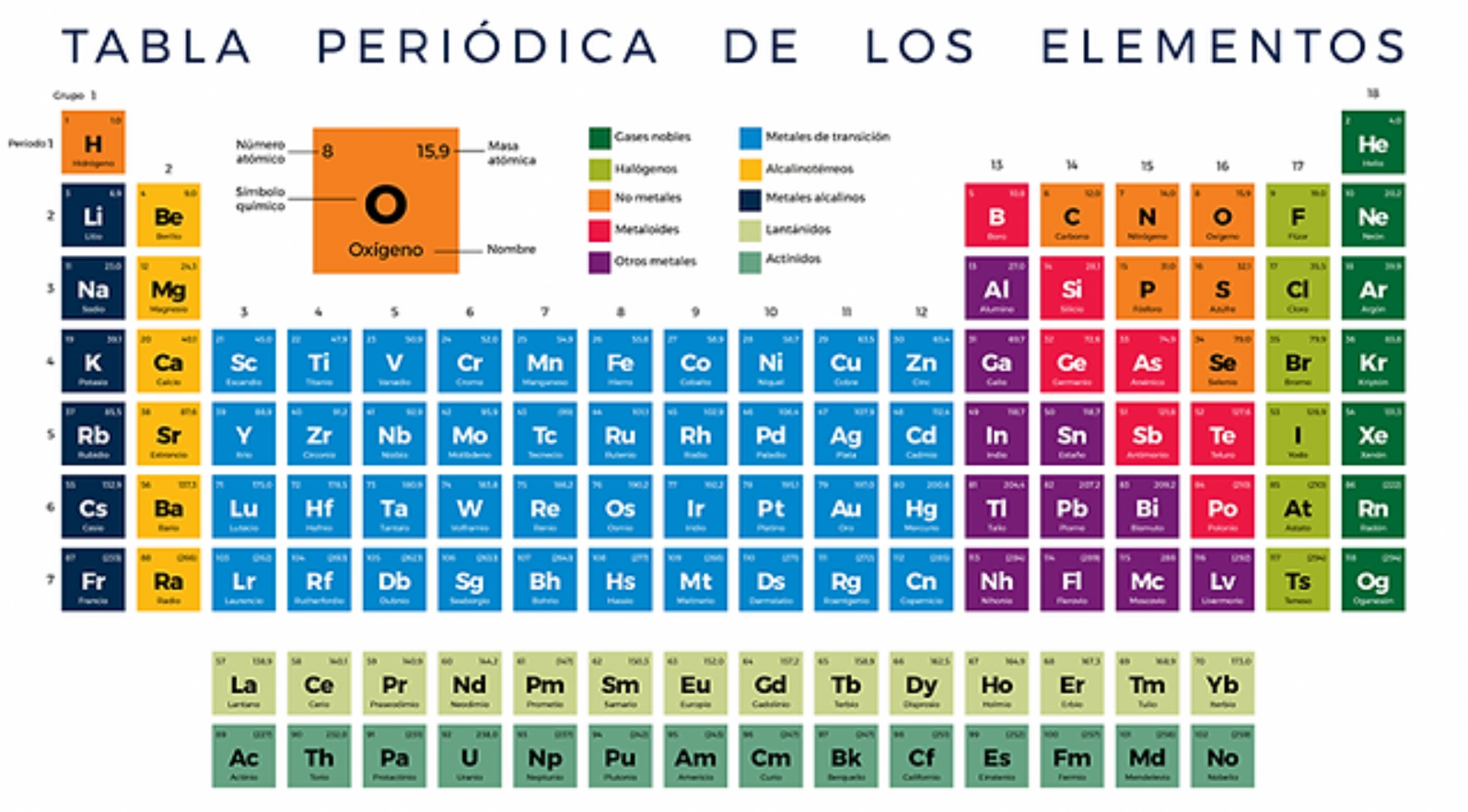
¿Por qué es importante la tabla periódica de los elementos?
La tabla periódica de los elementos es esencial para comprender la estructura y las propiedades de la materia. Permite identificar la relación entre los elementos y su comportamiento químico, así como predecir sus propiedades físicas y químicas. Además, la tabla periódica sirve como base para la nomenclatura química y para el desarrollo de diversas aplicaciones en ciencias como la biología, la medicina y la ingeniería.
Na tabla periódica
El sodio (Na) es uno de los elementos químicos presentes en la tabla periódica. Se encuentra en el grupo 1 y periodo 3, y su número atómico es 11. El sodio es un metal alcalino de color plateado y brillo metálico. Es altamente reactivo y se oxida rápidamente en presencia de oxígeno. El sodio tiene numerosas aplicaciones en la industria y es vital para el funcionamiento adecuado del organismo humano.
Propiedades y usos del sodio (Na)
El sodio es conocido por su alta conductividad eléctrica y se utiliza en la fabricación de baterías y otros dispositivos electrónicos. También es un componente esencial en la producción de vidrio, detergentes y productos químicos. En el ámbito biológico, el sodio desempeña un papel crucial en la regulación del equilibrio de agua y electrolitos en el cuerpo.
La tabla periódica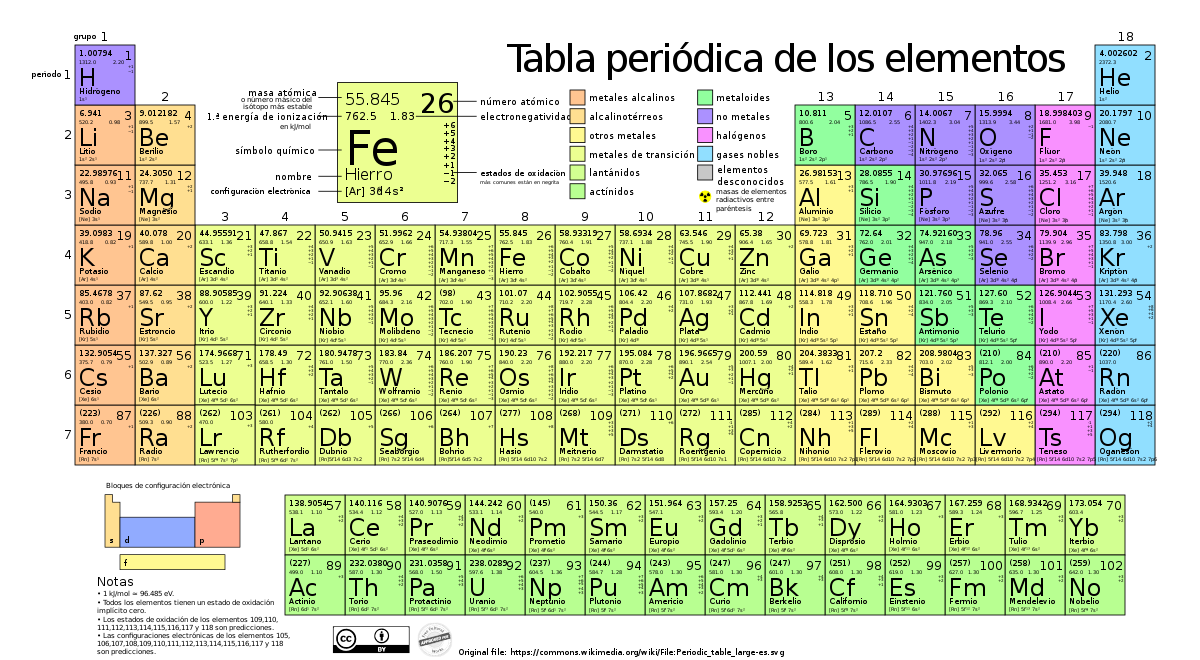
La tabla periódica es una representación gráfica de todos los elementos químicos conocidos hasta el momento. Cada elemento está dispuesto en casillas individuales, que contienen información relevante sobre sus características. Estas casillas están organizadas en filas horizontales llamadas periodos y columnas verticales conocidas como grupos.
Estructura y organización de la tabla periódica
La tabla periódica está organizada en base a la configuración electrónica de los elementos. Los periodos indican el número de capas electrónicas presentes en los átomos de los elementos, mientras que los grupos reflejan la similitud en las propiedades químicas. Los grupos se dividen en metales, no metales y metaloides, lo que proporciona información sobre las características físicas y químicas de los elementos.
Tabla periódica actualizada
La tabla periódica se ha actualizado a lo largo de los años a medida que se han descubierto nuevos elementos y se ha obtenido una mayor comprensión de las propiedades de los existentes. La versión actualizada más comúnmente utilizada es la tabla periódica de los elementos aprobada por la Unión Internacional de Química Pura y Aplicada (IUPAC, por sus siglas en inglés).
Nuevos elementos en la tabla periódica
En los últimos años, se han descubierto y sintetizado nuevos elementos que han sido añadidos a la tabla periódica. Estos elementos, como el nihonio (Nh), el moscovio (Mc) y el teneso (Ts), se encuentran en la séptima fila de la tabla periódica y pertenecen a la categoría de los superpesados.
Tabla periódica PDF
La tabla periódica en formato PDF es ampliamente utilizada como una herramienta de referencia para estudiantes, profesionales y entusiastas de la química. Un archivo PDF de la tabla periódica proporciona una representación clara y legible de todos los elementos, sus símbolos y propiedades. Estos archivos pueden descargarse e imprimirse para su uso personal o educativo.
Ventajas de utilizar una tabla periódica en formato PDF
Al utilizar una tabla periódica en formato PDF, se tiene la ventaja de poder hacer zoom, resaltar elementos específicos y acceder rápidamente a información detallada. Además, al ser un formato digital, es fácil de transportar y compartir en dispositivos electrónicos como computadoras, tabletas y teléfonos móviles.
¿Qué es la tabla periódica?
La tabla periódica es una representación sistemática y organizada de todos los elementos químicos conocidos. Fue desarrollada para clasificar los elementos según sus propiedades y proporcionar una visión general de la estructura de la materia. La tabla periódica es una herramienta fundamental en la química y desempeña un papel crucial en la comprensión y aplicación de los principios químicos.
Evolución histórica de la tabla periódica
La tabla periódica ha experimentado varios cambios y revisiones a lo largo de la historia. Su desarrollo comenzó en el siglo XIX con los trabajos de químicos como Dmitri Mendeléyev y Julius Lothar Meyer. A lo largo del tiempo, se han realizado ajustes en la organización de los elementos y se han añadido nuevos elementos a medida que se han descubierto.
Tabla periódica H
La «Tabla periódica H» es una referencia a la tabla periódica de los elementos en la que se muestra el hidrógeno (H) como el primer elemento. El hidrógeno es el elemento más ligero y abundante en el universo. Aunque se clasifica en el grupo 1, tiene propiedades únicas y no se comporta exactamente como los demás metales alcalinos.
Características del hidrógeno (H)
El hidrógeno es un gas incoloro y altamente inflamable. Se encuentra en forma molecular (H2) en la atmósfera terrestre y también forma parte de numerosos compuestos químicos, como el agua (H2O) y los hidrocarburos. El hidrógeno es importante en la producción de energía y se utiliza en pilas de combustible y otros procesos industriales.
¿Cuántos elementos tiene la tabla periódica?
La tabla periódica actualmente cuenta con 118 elementos conocidos. Estos elementos se encuentran distribuidos en los periodos y grupos de la tabla periódica, y cada uno tiene propiedades y características únicas. A lo largo de la historia, se han descubierto nuevos elementos y se han agregado a la tabla periódica a medida que se han obtenido pruebas científicas suficientes.
Elementos sintéticos y superpesados
Algunos de los elementos más pesados en la tabla periódica son elementos sintéticos que se han creado en laboratorios. Estos elementos tienen una vida media corta y se descomponen rápidamente. Además, se han descubierto elementos superpesados más allá del número atómico 118, pero su existencia y características aún están siendo investigadas.
Periodic table
La «periodic table» es el término en inglés utilizado para referirse a la tabla periódica de los elementos. Esta representación sistemática y organizada de los elementos químicos es reconocida internacionalmente y se utiliza en todo el mundo para el estudio y la investigación en química. La periodic table proporciona una visión general de los elementos y sus propiedades.
Grupos de la tabla periódica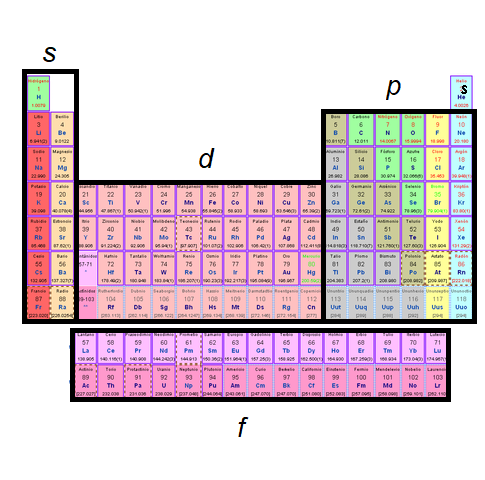
Los grupos en la tabla periódica son las columnas verticales que dividen los elementos en categorías y subcategorías. Cada grupo tiene características y propiedades químicas similares debido a la similitud en la configuración electrónica de los elementos. Los grupos se designan con números romanos del I al XVIII y también se les atribuyen nombres específicos, como los metales alcalinos, los halógenos y los gases nobles.
Características de algunos grupos destacados
- Grupo 1: Metales alcalinos. Incluye elementos como el sodio (Na), el potasio (K) y el litio (Li). Son altamente reactivos y tienen baja densidad.
- Grupo 17: Halógenos. Incluye elementos como el cloro (Cl), el flúor (F) y el yodo (I). Son altamente electronegativos y forman compuestos iónicos.
- Grupo 18: Gases nobles. Incluye elementos como el helio (He), el neón (Ne) y el argón (Ar). Son gases incoloros e inertes.
Línea del tiempo de la tabla periódica
La línea del tiempo de la tabla periódica muestra los hitos importantes en el desarrollo y evolución de la tabla periódica a lo largo de la historia. Comienza en el siglo XIX con los primeros intentos de clasificación de los elementos y continúa hasta la actualidad con los descubrimientos más recientes. La línea del tiempo destaca los principales científicos y sus contribuciones en la comprensión de la estructura y las propiedades de los elementos.
Actualizada tabla periódica
La tabla periódica se actualiza regularmente a medida que se descubren y se confirman nuevas propiedades y características de los elementos. La versión actualizada más comúnmente utilizada es la tabla periódica aprobada por la IUPAC. Esta versión incluye todos los elementos conocidos hasta la fecha y muestra información actualizada sobre su masa atómica, símbolo y configuración electrónica.
Importancia de mantener la tabla periódica actualizada
La actualización de la tabla periódica es esencial para reflejar con precisión la naturaleza de los elementos y sus propiedades. Además, el descubrimiento de nuevos elementos y el avance de la investigación científica requieren que se realicen ajustes en la tabla periódica para mantenerla relevante y útil en el campo de la química.
Familias de la tabla periódica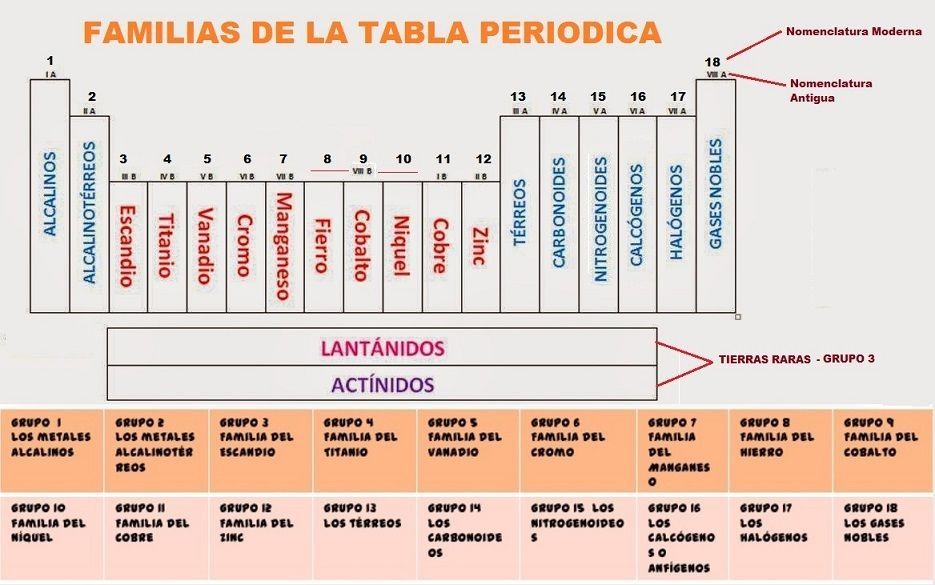
En la tabla periódica, los elementos se agrupan en familias basadas en sus propiedades químicas y características comunes. Estas familias son conjuntos de elementos que comparten comportamientos y tendencias químicas similares. Algunas de las familias más conocidas incluyen los metales alcalinos, los metales alcalinotérreos, los halógenos y los gases nobles.
Características y propiedades de algunas familias destacadas
- Metales alcalinos: Grupo 1. Son altamente reactivos y suelen formar compuestos iónicos con carga +1.
- Metales alcalinotérreos: Grupo 2. Son menos reactivos que los metales alcalinos y suelen formar compuestos iónicos con carga +2.
- Halógenos: Grupo 17. Son altamente electronegativos y tienden a formar compuestos iónicos con carga -1.
- Gases nobles: Grupo 18. Son gases inertes y no reactivos debido a su configuración electrónica estable.
Historia de la tabla periódica
La historia de la tabla periódica se remonta al siglo XIX, cuando varios científicos comenzaron a reconocer patrones en las propiedades de los elementos químicos. Uno de los hitos más significativos fue el trabajo independiente de Dmitri Mendeléyev y Julius Lothar Meyer, quienes propusieron una versión temprana de la tabla periódica basada en la ordenación de los elementos por su masa atómica y propiedades químicas.
Contribuciones de Dmitri Mendeléyev
Dmitri Mendeléyev, un químico ruso, es ampliamente reconocido como el padre de la tabla periódica moderna. En 1869, Mendeléyev propuso su versión de la tabla periódica, en la que los elementos se organizaban por su masa atómica creciente y sus propiedades químicas. Además, Mendeléyev dejó espacios vacíos para elementos aún no descubiertos y pudo predecir con precisión las propiedades de estos elementos desconocidos.
Metales en la tabla periódica
La tabla periódica incluye una amplia gama de metales, que constituyen la mayoría de los elementos presentes. Los metales se caracterizan por ser buenos conductores del calor y la electricidad, tener brillo metálico y ser maleables y dúctiles. Algunos ejemplos de metales en la tabla periódica son el hierro (Fe), el cobre (Cu) y el oro (Au).
Propiedades y usos de los metales
Los metales tienen una amplia variedad de aplicaciones en la industria y la vida cotidiana. Se utilizan en la construcción de estructuras, la fabricación de utensilios, la generación de energía y la electrónica, entre otros campos. Los metales también juegan un papel crucial en la biología, ya que son componentes esenciales en los organismos vivos.
Períodos de la tabla periódica
Los períodos en la tabla periódica son las filas horizontales que separan los elementos. Hay un total de siete períodos en la tabla periódica, y cada uno indica el número de capas electrónicas que rodean al núcleo de un átomo. A medida que se avanza en un período de la izquierda a la derecha, se agregan electrones a la capa más externa de los átomos.
Tendencias y cambios en los períodos
A medida que se avanza en un período de la tabla periódica, se observan cambios en las propiedades y características de los elementos. Por ejemplo, los átomos tienden a volverse más pequeños a medida que se avanza en un período debido al aumento de la carga nuclear efectiva. Además, las propiedades químicas y físicas de los elementos pueden variar a medida que se avanza en un período.
Tabla periódica grande y clara
Existen diferentes versiones de la tabla periódica que varían en tamaño y claridad de la presentación. Una tabla periódica grande y clara es especialmente útil para su uso en entornos educativos, laboratorios y otros lugares donde se requiere una referencia visual de los elementos. Estas tablas periódicas suelen tener un tamaño ampliado y presentan los elementos con una fuente legible y símbolos claros.
Utilidad de una tabla periódica grande y clara
Una tabla periódica grande y clara facilita la identificación rápida de los elementos y permite una visualización detallada de las propiedades y características de cada uno. Es especialmente útil para estudiantes y profesionales de la química, ya que proporciona una referencia visual accesible y legible.
Electronegatividad en la tabla periódica
La electronegatividad es una propiedad química que mide la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. La electronegatividad varía a lo largo de la tabla periódica y muestra tendencias específicas. Los elementos más electronegativos se encuentran en la esquina superior derecha de la tabla periódica, como el flúor (F) y el oxígeno (O), mientras que los elementos menos electronegativos se encuentran en la esquina inferior izquierda, como los metales alcalinos.
Importancia de la electronegatividad
La electronegatividad es una propiedad fundamental en la formación de enlaces químicos y determina la polaridad de las moléculas y la distribución de carga en los compuestos. Es una herramienta clave para comprender la reactividad y las interacciones químicas entre diferentes elementos.
Tabla periódica completa
La tabla periódica completa es una representación de todos los elementos químicos conocidos, organizados según su estructura y propiedades. Incluye los elementos desde el hidrógeno (H) hasta el oganesón (Og), el elemento más recientemente descubierto. La tabla periódica completa muestra información sobre la masa atómica, el símbolo, la configuración electrónica y otras propiedades de cada elemento.
Utilidad de la tabla periódica completa
La tabla periódica completa es una herramienta esencial en la química y se utiliza en una variedad de aplicaciones, desde la educación y la investigación hasta la industria. Proporciona una visión general de la estructura y las características de los elementos, permitiendo a los químicos comprender mejor las propiedades y tendencias de los elementos y utilizarlos de manera eficiente.
Tabla periódica con números de oxidación
Los números de oxidación son valores que indican la carga eléctrica que un átomo adquiere o cede al formar un compuesto químico. Una tabla periódica con números de oxidación muestra estos valores para cada elemento químico. Los números de oxidación pueden ser positivos, negativos o cero, dependiendo de la capacidad de un átomo para ganar, perder o compartir electrones en un enlace químico.
Importancia de los números de oxidación
Los números de oxidación son fundamentales para el estudio de la química y la comprensión de las reacciones químicas. Ayudan a determinar cómo los átomos se combinan entre sí y qué tipo de compuestos se forman. La tabla periódica con números de oxidación permite a los químicos identificar rápidamente los números de oxidación más comunes para cada elemento y facilita el análisis y la predicción de las reacciones químicas.
Tabla periódica de los elementos químicos
La tabla periódica de los elementos químicos es una representación visual de los elementos conocidos organizados según su número atómico, configuración electrónica y propiedades químicas. Es una herramienta fundamental en la química y proporciona una estructura sistemática para el estudio de los elementos y sus interacciones.
Utilidad de la tabla periódica de los elementos químicos
La tabla periódica de los elementos químicos es una referencia invaluable para los químicos y estudiantes de química. Permite una comprensión ordenada y estructurada de los elementos y sus propiedades, y es una herramienta esencial para la predicción y el análisis de las reacciones químicas. La tabla periódica también es utilizada en otros campos científicos, como la física y la biología, donde los elementos desempeñan un papel crucial.
Tabla periódica electronegatividad
La electronegatividad es una propiedad química importante que indica la tendencia de un átomo a atraer electrones hacia sí mismo en un enlace químico. La tabla periódica electronegatividad muestra los valores de electronegatividad de cada elemento químico. Los elementos más electronegativos se encuentran en la esquina superior derecha de la tabla periódica, mientras que los elementos menos electronegativos se encuentran en la esquina inferior izquierda.
Interpretación de la tabla periódica electronegatividad
La tabla periódica electronegatividad permite comparar la capacidad de los diferentes elementos para atraer electrones. Cuanto mayor es el valor de electronegatividad, mayor es la atracción de electrones. Esto es útil para comprender la polaridad de los enlaces químicos y la formación de moléculas y compuestos.
Preguntas frecuentes (FAQs)
- ¿Cuántos elementos hay en la tabla periódica? R: Actualmente, la tabla periódica contiene 118 elementos conocidos.
- ¿Qué significan los números de oxidación en la tabla periódica? R: Los números de oxidación indican la carga eléctrica que un átomo adquiere o cede al formar un compuesto químico.
- ¿Cuál es la importancia de la electronegatividad en la tabla periódica? R: La electronegatividad es crucial para comprender la formación de enlaces químicos y las propiedades de los compuestos.
- ¿Cuál es el objetivo de una tabla periódica grande y clara? R: Una tabla periódica grande y clara facilita la identificación rápida de los elementos y proporciona una referencia visual accesible.
- ¿Quién es considerado el padre de la tabla periódica moderna? R: Dmitri Mendeléyev es ampliamente reconocido como el padre de la tabla periódica moderna debido a su contribución significativa en su desarrollo.
- ¿Cuál es el elemento más liviano de la tabla periódica? R: El hidrógeno (H) es el elemento más liviano de la tabla periódica.
- ¿Cuáles son los elementos más reactivos en la tabla periódica? R: Los metales alcalinos, como el sodio (Na) y el potasio (K), son algunos de los elementos más reactivos de la tabla periódica.
- ¿Cuál es el símbolo del elemento químico del oro? R: El símbolo del oro en la tabla periódica es Au, que proviene del término latino «aurum».
- ¿Cuál es el nombre y símbolo del elemento químico del hierro? R: El nombre del elemento químico del hierro es hierro, y su símbolo en la tabla periódica es Fe.
- ¿Cuál es el elemento más abundante en la corteza terrestre? R: El oxígeno (O) es el elemento más abundante en la corteza terrestre, representando aproximadamente el 46% de la masa total.
- ¿Cuál es el número atómico del carbono en la tabla periódica? R: El carbono tiene un número atómico de 6, lo que significa que tiene 6 protones en su núcleo.
- ¿Qué son los elementos de transición en la tabla periódica? R: Los elementos de transición son aquellos ubicados en los bloques d de la tabla periódica. Son conocidos por su capacidad para formar compuestos con diferentes estados de oxidación.
- ¿Cuál es el elemento químico más pesado de la tabla periódica? R: El elemento químico más pesado de la tabla periódica es el oganesón (Og), que tiene un número atómico de 118.
- ¿Cuál es el símbolo del elemento químico del nitrógeno? R: El símbolo del nitrógeno en la tabla periódica es N.
- ¿Cuál es el elemento más denso en la tabla periódica? R: El elemento más denso en la tabla periódica es el osmio (Os), que tiene una densidad aproximadamente 22 veces mayor que la del agua.